Cục Quản lý Dược (Bộ Y tế) chưa nhận được bất kỳ báo cáo phản ánh tác dụng không mong muốn của thuốc Avastin điều trị ung thư liên quan đến việc bệnh nhân bị mất thị lực tại Pakistan.
Theo thông tin từ Cục Quản lý Dược (Bộ Y tế), tại Việt Nam, tính đến ngày 27/9/2023, Cục Quản lý Dược chưa nhận được bất kỳ báo cáo phản ánh tác dụng không mong muốn của thuốc Avastin liên quan đến việc bệnh nhân bị mất thị lực sau khi sử dụng thuốc Avastin.
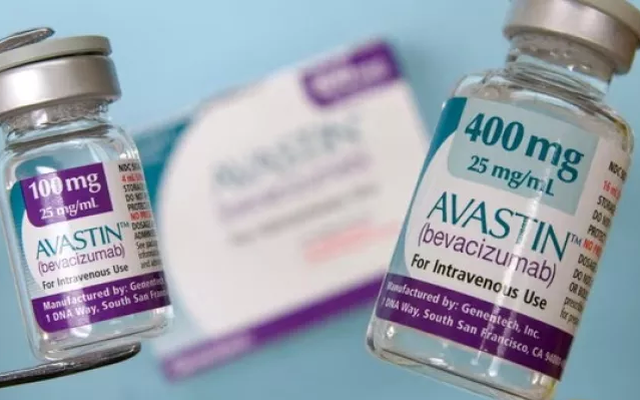
Trước đó, Cơ quan chức năng tại Pakistan thông báo tạm cấm sử dụng một loại thuốc điều trị ung thư (Avastin) được phân phối bởi hãng dược Roche (Thụy Sĩ) để điều tra, do có 12 bệnh nhân bị mù sau khi tiêm thuốc.
Theo Cục Quản lý Dược, Văn phòng Đại diện F. Hoffmann La Roche Ltd. có công văn số RA/02/09/2023 báo cáo các thông tin cập nhật về việc điều tra liên quan đến thuốc Avastin nêu trên.
Cụ thể, tại Pakistan, khoảng 12 người bệnh đã bị mất thị lực sau khi sử dụng thuốc tiêm do nhà cung cấp bất hợp pháp Genius Pharmaceutical Service cung ứng. Thuốc được ghi nhãn "Inj. Avastin 1,25mg/0,05ml" gây nhận định sai lệch đây là sản phẩm của Roche.
Thuốc Avastin của Roche không được phê duyệt để sử dụng cho bất kỳ chỉ định nào trên mắt. Cơ sở Genius Pharmaceutical Service đã cung ứng/pha loãng/đóng gói lại thuốc với liều lượng 1,25mg/0,5ml trong điều kiện mất vệ sinh và không được phê duyệt.
Tại Việt Nam, thuốc Avastin đã được 4 giấy đăng ký lưu hành còn hiệu lực, gồm:
1. Thuốc Avastin, hoạt chất: Bevacizumab 100mg/4ml, loại hộp 4ml, SĐK: 400410250123 (QLSP-1118- 18), cơ sở sản xuất: Roche Diagnostics GmbH, Đức.
2. Thuốc Avastin, hoạt chất Bevacizumab 400mg/16ml, hộp 16 ml, SĐK: 400410250123 (QLSP-1118- 18), cơ sở sản xuất: Roche Diagnostics GmbH, Đức.
3. Thuốc Avastin, hoạt chất Bevacizumab 100mg/4ml, hộp 4ml, SĐK: QLSP-1010-17, cơ sở sản xuất: F. Hoffmann-La Roche Ltd., Thụy Sỹ.
4. Thuốc Avastin, hoạt chất Bevacizumab 400mg/16ml, hộp 16 ml, SĐK: QLSP-1010-17, cơ sở sản xuất F. Hoffmann-La Roche Ltd., Thụy Sỹ.
Thuốc Avastin được cấp giấy đăng ký lưu hành tại Việt Nam được chỉ định điều trị một số loại ung thư như trực tràng, phổi, thận, biểu mô buồng trứng...
Thuốc cảnh báo "không được sử dụng cho tiêm vào bên trong dịch kính". Cụ thể, thuốc có thể gây rối loạn về thị giác. Các trường hợp riêng lẻ và các nhóm biến cố bất lợi nghiêm trọng ở mắt đã được báo cáo sau khi tiêm. Những phản ứng này bao gồm nhiễm trùng nội nhãn, viêm nội nhãn cầu, như viêm nội nhãn vô trùng, viêm màng bồ đào và viêm dịch kính, băng võng mạc, rách biểu mô sắc tố võng mạc, tăng nhãn áp, xuất huyết nội nhãn như xuất huyết dịch kính hoặc xuất huyết võng mạc và xuất huyết kết mạc. Một số các biến cố đã dẫn đến mất thị lực ở các mức độ khác nhau, bao gồm mù vĩnh viễn.