Thu hồi trên toàn quốc lô thuốc điều trị ung thư nhập khẩu từ Đức
Cục Quản lý Dược (Bộ Y tế) vừa có Công văn số 1310/QLD-CL ngày 8/5/2024 gửi Sở Y tế các tỉnh, thành phố trực thuộc Trung ương; Công ty TNHH dược phẩm và hóa chất Nam Linh (Đ/c: 915/27/12 Đường Lê Văn Lương, Ấp 3, Xã Phước Kiển, Huyện Nhà Bè, Tp.Hồ Chí Minh) về việc thông báo thu hồi thuốc vi phạm mức độ 3 .
Căn cứ vào các quy định về quản lý dược hiện hành của Việt Nam. Căn cứ Công văn số 290/TTrB-P3 đề ngày 04/04/2024 của Thanh tra Bộ Y tế về việc chuyển thông tin, tài liệu về lô thuốc nhập khẩu vi phạm không có tờ hướng dẫn sử dụng bằng tiếng Việt và các tài liệu kèm theo.
Theo đó, trong quá trình thanh tra tại Công ty TNHH Dược phẩm và hóa chất Nam Linh (Đ/c: 915/27/12 Đường Lê Văn Lương, Ấp 3, Xã Phước Kiển, Huyện Nhà Bè, Tp.Hồ Chí Minh), Đoàn Thanh tra theo Quyết định số 45/QĐ-TTrB ngày 27/11/2023 của Thanh tra Bộ Y tế đã kiểm tra xác xuất và phát hiện 01 lô thuốc Temozolomid Ribosepharm 100 mg, số GĐKLH VN2-626-17, Số lô: 2J6001, NSX: 17/8/2022, HD: 31/8/2025;
Quy cách: hộp 01 chai 05 viên nang cứng; Nhà sản xuất: Công ty Haupt Pharma Amareg GmbH (Đức); Chủ sở hữu sản phẩm: Công ty Hikma Pharma GmbH (Đức); Nhà đăng ký và nhập khẩu tại Việt Nam là Công ty TNHH Dược phẩm và hóa chất Nam Linh không có tờ hướng dẫn sử dụng bằng tiếng Việt theo quy định.
Một lô thuốc điều trị một số bệnh ung thư não, nhập khẩu tại Đức vừa bị thu hồi trên toàn quốc do vi phạm mức độ 3.
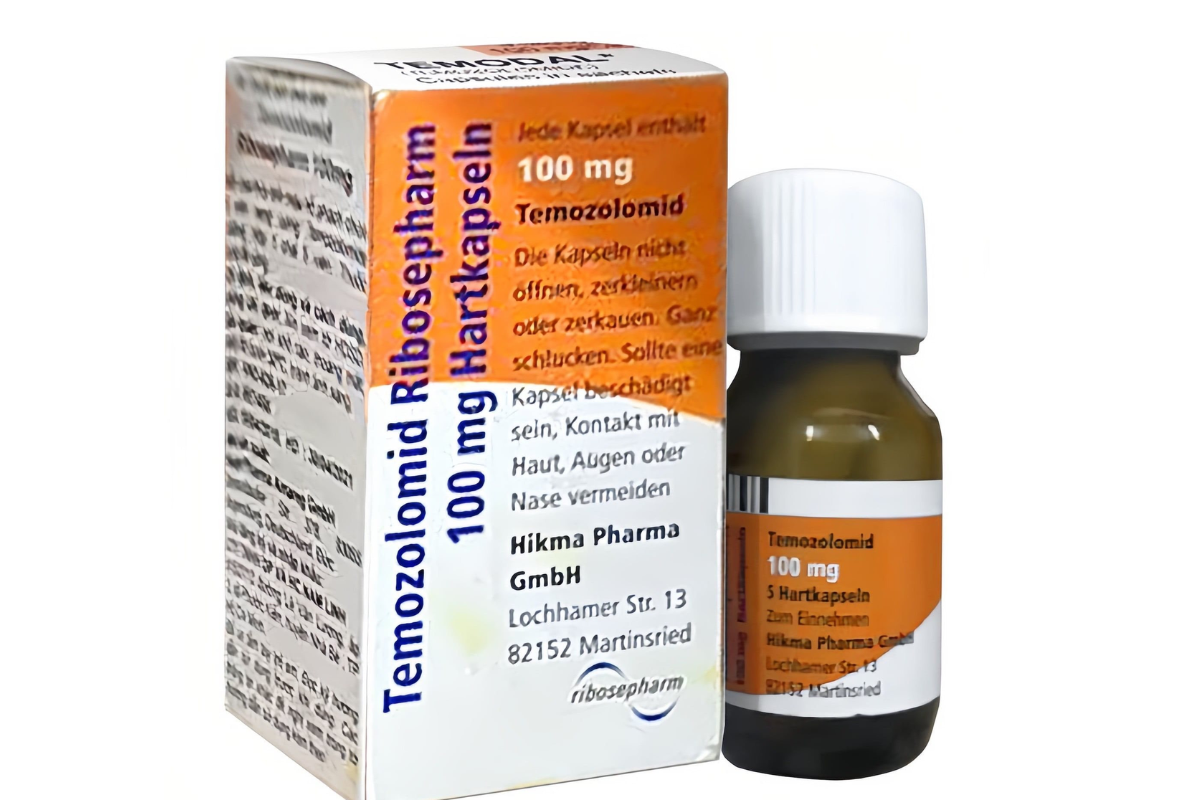
Căn cứ những sai phạm trên, Cục Quản lý Dược thông báo: Thu hồi toàn quốc thuốc Temozolomid Ribosepharm 100 mg, số GĐKLH VN2-626-17, Số lô: 2J6001, NSX: 17/8/2022, HD: 31/8/2025 do Công ty Haupt Pharma Amareg GmbH (Đức) sản xuất, Công ty TNHH Dược phẩm và hóa chất Nam Linh nhập khẩu.
Công ty TNHH Dược phẩm và hóa chất Nam Linh phối hợp với nhà cung cấp và phân phối thuốc: Trong thời hạn 02 ngày kể từ ngày ký Công văn này, gửi thông báo thu hồi tới các cơ sở bán buôn, bán lẻ, sử dụng thuốc Temozolomid Ribosepharm 100 mg, số GĐKLH VN2-626-17, Số lô: 2J6001, NSX: 17/8/2022, HD: 31/8/2025 do Công ty Haupt Pharma Amareg GmbH (Đức) sản xuất, Công ty TNHH Dược phẩm và hóa chất Nam Linh nhập khẩu và tiến hành thu hồi toàn bộ lô thuốc vi phạm mức độ 3 nêu trên.
Đồng thời, gửi báo cáo thu hồi về Cục Quản lý Dược trong vòng 33 ngày kể từ ngày ký Công văn này, hồ sơ thu hồi bao gồm số lượng nhập khẩu, ngày nhập khẩu, số lượng thu hồi, các bằng chứng về việc thực hiện thu hồi tại các cơ sở bán buôn, bán lẻ, sử dụng đã mua thuốc theo quy định tại Thông tư số 11/2018/TT-BYT ngày 04/05/2018 của Bộ Y tế quy định về chất lượng thuốc, nguyên liệu làm thuốc.
Cục Quản lý Dược đề nghị Sở Y tế các tỉnh thành phố trực thuộc Trung ương, Y tế các ngành thông báo cho các cơ sở kinh doanh, sử dụng thuốc thu hồi lô thuốc vi phạm mức độ 3 nêu trên, công bố thông tin về quyết định thu hồi thuốc trên Trang thông tin điện tử của Sở, kiểm tra và giám sát các đơn vị thực hiện thông báo này; xử lý những đơn vị vi phạm theo quy định hiện hành; báo cáo về Cục Quản lý Dược và các cơ quan chức năng có liên quan.
Cục Quản lý Dược cũng Đề nghị Sở Y tế thành phố Hồ Chí Minh kiểm tra và giám sát Công ty TNHH Dược phẩm và hóa chất Nam Linh thực hiện việc thu hồi và xử lý thuốc bị thu hồi theo quy định.
